Test per la Malattia di Lyme
Noto anche come: Test per la Borreliosi; Test degli anticorpi anti-Borrelia; Ricerca di Borrelia DNA mediante amplificazione genica (PCR); Test western blot per ricerca anticorpi anti Borrelia; Anticorpi di Lyme IgM/IgG con Western Blot; Algoritmo sierologico a due livelli
Nome ufficiale: Test per malattia di Lyme
Ultima Revisione: 30.12.2019
Ultima Modifica: 03.07.2021

Articolo approvato dal Comitato editoriale di labtestsonline.org ed in corso di revisione da parte del Comitato editoriale italiano
In Sintesi
Quando?
Quando sono presenti sintomi o segni (ad esempio lesioni cutanee sospette) della malattia di Lyme, specialmente a carico di soggetti che vivono in (o che hanno recentemente visitato) aree boschive o rurali in cui è comune la presenza di zecche e che sospettano di essere stati punti.
Il campione
Un campione di sangue prelevato da una vena del braccio. Se sono presenti segni o sintomi che suggeriscono il coinvolgimento del sistema nervoso centrale(meningite, encefalite, ecc), l’operatore sanitario raccoglie, in ambito ospedaliero, un campione di liquido cerebrospinale(CSF) usando una procedura chiamata puntura lombare o rachicentesi.
La preparazione
No, nessuna.
L'Esame
La malattia di Lyme (ML) prende il nome dall’omonima cittadina del Connecticut in cui furono descritti i primi casi nel 1975. Si tratta di un’infezione causata da batteri spiraliformi appartenenti alla famiglia Spirochetacee, genere Borrelia burgdorferi complex sensu lato, che comprende più di 20 specie tra cui la recente B. mayonii, identificata in Nord America e in Europa nel 2016. La ML è diffusa in molte zone del Nord America, in Europa e in Asia. Se non adeguatamente trattata, l'infezione può diffondersi nell’arco di alcuni mesi con diversi quadri clinici, in particolare patologie neurologiche, cutanee, articolari e cardiache.
In Nord America e in Europa le manifestazioni cliniche sono fondamentalmente simili ma differiscono per alcuni aspetti, a causa della diversa distribuzione delle genospecie di Borrelia nelle 2 aree geografiche: in Europa infatti sono presenti B. afzelii (manifestazioni cutanee), B. garinii (neuroborreliosi), B. burgdorferi sensu stricto (neuroborreliosi e artrite) e occasionalmente B. spielmanii, mentre in Nord America le uniche specie patogene sono la B. burgdorferi sensu stricto e la B. mayonii.
Casi gravi di meningoencefalite indotta da B. miyamotoi sono stati descritti in pazienti immunocompromessi.
L’infezione viene trasmessa all’uomo dalla puntura di zecche del genere Ixodes (ricinus e persulcatus in Europa e Asia, scapularis e pacificus in USA, nella loro forma immatura (ninfa), che è grande solo 5 millimetri e quindi spesso non viene vista. Le zecche devono rimanere adese alla cute per almeno 36 ore per trasmettere l’infezione all’uomo, che è un ospite occasionale. Probabilmente l’infezione viene trasmessa anche dalle zecche del cane Amblyomma e Dermacentor. Le zecche adulte hanno scarso ruolo nella trasmissione dell’infezione. I principali serbatoi dell’infezione sono rappresentati da mammiferi selvatici di media o piccola taglia (roditori, caprioli, volpi, lepri, ricci, scoiattoli, ghiri). In Europa, oltre ai mammiferi citati, anche i cinghiali e diverse specie di uccelli (passeri, merli, fagiani, uccelli acquatici) rappresentano un serbatoio in aumento per le forme immature di zecche. Gli habitat ottimali sono rappresentati da boschi di latifoglie o misti, ma le zecche di I. ricinus e persulcatussi possono trovare anche nelle brughiere, nei prati erbosi e nei parchi urbani.
La diffusione e la trasmissione del vettore, e di conseguenza l’incidenza della malattia, dipendono da vari fattori, come i cambiamenti climatici, l’attività dell’uomo sull’habitat, la densità degli animali selvatici sul territorio. In particolare, il riscaldamento globale aumenta l’estensione di habitat adatti alla sopravvivenza e proliferazione delle zecche, che sono arrivate anche in Canada, in cui da alcuni anni è comparsa la malattia. L’aumento del numero di casi di ML dal 1991 al 2014 è stato considerato un indicatore di cambiamento climatico in USA: infatti in alcuni Stati si è passati da circa 4 casi per 100.000 abitanti notificati al CDC a 30-50 casi per 100.000 abitanti (Connecticut, Pennsylvania, New Hampshire, Maine, Vermont, Delaware, Rhode Island). In Europa l'habitat di I. ricinus si è notevolmente ampliato negli ultimi decenni e la zecca si è diffusa in aree più settentrionali e a quote più elevate. Le zecche possono trasmettere altri agenti infettivi, fra cui Rickettsiae, Flavivirus (encefalite trasmessa da zecche), Ehrlichia, Anaplasma, Babesia, Bartonella.
Per numero di casi, la malattia di Lyme è seconda solo alla malaria fra le patologie che richiedono un vettore artropode per la sua diffusione ed è la più comune malattia umana trasmessa da zecche negli Stati Uniti e in Europa. In USA la ML è una malattia soggetta a notifica fin dal 1991. Nel periodo 2009-2018 sono stati segnalati al CDC come confermati o sospetti circa 30.000 casi all’anno; nel 2018 sono stati segnalati circa 33.600 casi, di cui 23.500 confermati e 10.100 sospetti. Considerando che il numero di persone malate in USA potesse essere largamente sottostimato, a causa delle suddette modifiche climatiche, nel periodo 2005-2010 sono stati stimati (attraverso diverse fonti) circa 330.000 casi all’anno, dieci volte di più dei casi segnalati. Recentemente in USA sono state effettuate nuove stime (Emerging Infectious Disease 2021), che indicano per gli anni 2010-2018 circa 476.000 casi all’anno. Inoltre, una scarsa sensibilità dei test di laboratorio disponibili è la principale causa di sottostima dei pazienti infetti. Negli USA le infezioni asintomatiche si verificano in circa il 10% degli individui infetti, mentre in Europa questo numero risulta essere di molto superiore.
In Europa i dati di incidenza dell’infezione sono molto più scarsi dal momento che la borreliosi è stata inclusa dalla Commissione Europea nella lista di malattie sottoposte a sorveglianza epidemiologica solo dal 2018, utilizzando una definizione di caso confermato, proposta da vari Gruppi di Studio europei dalla fine del 1990 e sollecitata nel 2010, condivisa fra ECDC ed esperti di stati membri. Dati del 2015 indicavano una stima di 85.000 casi all’anno (rispetto a 35.000 casi nel 2010) e una revisione della letteratura del 2017 ha stimato una incidenza media di ML in Europa occidentale di 22 casi per 100 000 persone all’anno (con punte di 84 per 100.000 in Francia nel 2016, di 61 per 100.000 in Finlandia nel 2014). Diverse segnalazioni hanno riportato che l’incidenza di ML è più alta nei Paesi del centro, est e nord Europa: Slovenia, Austria, Polonia, Austria, Svezia, Olanda, Germania e Francia.
In Italia, dal 1983, anno in cui è stato segnalato il primo caso a Genova, le Regioni maggiormente interessate sono quelle del Nord (Friuli-Venezia Giulia, Liguria, Veneto, Emilia-Romagna, Trentino-Alto Adige) mentre nelle Regioni centro-meridionali e nelle isole le segnalazioni sono sporadiche. Secondo i dati raccolti dal Ministero della Sanità, nel periodo 1992-1998 si sarebbero verificati, in Italia, circa 1.000 casi di ML. La reale incidenza è però sconosciuta a causa di dati molto discordanti fra le varie regioni e perché in Italia la ML rientra nella classe 5 dell’elenco delle malattie infettive e diffusive a segnalazione obbligatoria previste dal Decreto Ministeriale 15 dicembre 1990, con la sola comunicazione annuale da parte della regione dei casi totali accertati al Ministero della Salute. In Italia la ML rientra inoltre nella lista delle malattie rare, con esenzione completa dal ticket per gli accertamenti necessari.
Un vaccino ricombinante è stato sviluppato per uso umano e approvato dalla FDA in USA nel 1998, ma ritirato nel 2002 dalla Ditta produttrice. Al momento attuale continuano gli studi per metterlo a punto. Diversi vaccini sono disponibili per i cani, anche se la protezione non è assoluta sul territorio europeo, a causa della presenza di diversi genotipi di Borrelia. Per questi animali tuttavia sono disponibili collari antiparassitari, efficaci anche contro l’infestazione da zecche, da utilizzare dalla primavera alla fine dell’estate. É comunque sempre opportuno, dopo avere frequentato zone rurali o boschive, ispezionare accuratamente il proprio cane ed eventualmente rimuovere le zecche il prima possibile.
Le manifestazioni cliniche della malattia di Lyme sono multiformi e possono simulare diverse affezioni cutanee e neurologiche. Possono idealmente essere classificate in tre stadi, che si susseguono temporalmente, anche se alcune di queste fasi possono essere assenti o possono presentarsi in modo atipico.
- Fase precoce localizzata; la prima e più frequente manifestazione della Borreliosi, che si osserva nel 70-80% dei casi, è la lesione cutanea denominata eritema migrante (EM), in passato chiamata eritema cronico migrante, che si manifesta entro pochi giorni (range 7-28) intorno al morso della zecca. La lesione inizia come una macchia con evidenti bordi rossastri privi di rilievo che si espande ad anello nel corso dei giorni successivi, con o senza schiarimento centrale, fino ad un diametro di almeno 5 centimetri. La lesione non produce dolore o prurito, ma può essere calda al tatto. Le zone più frequentemente interessate sono l'ascella, la parte posteriore del ginocchio, il collo, il cuoio capelluto e le orecchie. L’EM può essere accompagnato da astenia, febbre, linfadenopatia, mal di testa, rigidità nucale, dolori articolari e muscolari. Molto spesso l’individuo non ricorda di essere stato punto. L’EM si può risolvere anche senza trattamento antibiotico. Una lesione eritematosa anulare che insorge dopo alcune ore dalla puntura è una reazione di ipersensibilità e non deve essere considerata EM. La diagnosi di EM è basata sui sintomi clinici e il paziente deve essere immediatamente trattato, senza attendere i risultati dei test sierologici, che in questa fase possono risultare ancora negativi. Raramente, quando la sede del morso di zecca è a livello del lobo dell’orecchio, dell’areola mammaria o dello scroto, alcuni pazienti possono manifestare come segno precoce di infezione. Il linfocitoma borreliale si caratterizza per la comparsa di un nodulo rosso bluastro. Questa lesione può persistere per alcuni mesi se non trattata e può essere scambiata per linfoma cutaneo a causa dell’intenso infiltrato linfocitario associato. Il linfocitoma borreliale si osserva in Europa ma non in USA, in quanto è generalmente causato da Borrelia afzelii.
- Fase precoce disseminata; dopo giorni-settimane dal morso della zecca, la Borrelia può diffondere a diversi organi attraverso il sistema linfatico o ematico. In particolare nel 10-15% dei soggetti non trattati si possono osservare sintomi neurologici noti come Neuroborreliosi precoce: meningite linfocitaria (con linfocitosi liquorale e aumento delle proteine), meningoradicolite (sindrome di Bannwarth in Europa) con dolore radicolare intenso (non controllabile con antidolorifici) e paresi; paralisi dei nervi cranici (più frequentemente del nervo facciale, soprattutto se il morso si trova nella zona vicino all’orecchio), altre radicolopatie o alterazioni demielinizzanti rilevabili all’imaging cerebrale. Raramente, in Europa, soprattutto nei bambini, si osserva dopo circa 15 giorni un eritema simile a quello della Rosolia (eritema roseolico), talvolta coesistente con EM. Altre rare complicanze possono essere rappresentate da interessamento cardiaco (cardite di Lyme) con il manifestarsi di aritmie, blocco atrioventricolare e pericardite.
- Fase tardiva; dopo diversi mesi (circa 6) dal morso di zecca, in soggetti non trattati o trattati in modo inadeguato, possono comparire episodi intermittenti (della durata di 2-3 anni), seguiti dallo sviluppo di una forma cronica, che può essere rappresentata da:
- Artrite di Lyme, che si osserva nel 60% dei soggetti, interessa generalmente le ginocchia, i polsi e l’articolazione temporo-mandibolare, con gonfiore, dolore e calcificazione dei tessuti molli periarticolari, difficile da distinguere da artrite dovuta ad altre cause;
- Sintomi neurologici cronici con neuropatie periferiche, difficoltà di concentrazione e di memoria, sensazione di malessere generale; neuroborreliosi tardiva che si presenta come un'encefalomielite e può essere confusa con la sclerosi multipla;
- Interessamento oculare con comparsa di congiuntivite, episclerite, iridociclite, uveite o cheratite (fotofobia, bruciore, prurito, riduzione della vista, ecc);
- Una particolare manifestazione cutanea, denominata Acrodermatite cronica atrofica (ACA), osservata in Europa, perché causata da Borrelia afzelii in soggetti di 50-60 anni. La manifestazione è caratterizzata dalla comparsa di placche rosso-cianotiche, localizzate a livello delle superfici estensorie degli arti, in prossimità delle articolazioni delle mani e dei piedi con atrofia della cute, del sottocute e del tessuto muscolare sottostante.
La Borrelia è in grado di attraversare la barriera placentare e può causare raramente aborto o una forma congenita manifesta. È importante segnalare che il 95% dei casi materni trattati con antibiotici non hanno trasmesso l’infezione.
La diagnosi di malattia di Lyme è difficile e dovrebbe basarsi principalmente sulle manifestazioni cliniche (che sono polimorfe e coinvolgono vari organi) e sulla pregressa esposizione a zecche. Nella maggior parte dei casi il supporto dei test di laboratorio è essenziale a causa della natura non specifica di molti sintomi.
Gli esami di laboratorio si dividono in due grandi categorie: i test diretti, che si basano sulla ricerca colturale del batterio e del suo materiale genetico, e i metodi indiretti, che cercano invece una risposta immunitaria specifica (anticorpi IgG e IgM) del paziente contro la Borrelia.
Esame colturale
La Borrelia può essere coltivata su terreni specifici (ed eventualmente osservata al microscopio con colorazione argentica di Steiner) da vari campioni clinici: biopsie cutanee dell’eritema migrante e dell'acrodermatite cronica atrofica, liquido cerebrospinale, sangue intero, biopsia di linfocitoma borreliosico.
Nonostante sia stato per anni considerato il ‘gold standard’, l’esame colturale oggi non è utilizzato nella pratica clinica, in quanto è tecnicamente indaginoso, richiede tempi lunghi (circa 7 giorni) ed è meno sensibile dell’amplificazione genica. È invece ancora utilizzato a scopo di ricerca.
Amplificazione genica mediante PCR
Un altro metodo diretto per la rilevazione di B. burgdorferi senso latu è la ricerca del materiale genetico del batterio con metodo PCR (polymerase chain reaction) da vari campioni: (biopsie cutanee di lesioni sospette per eritema migrante o acrodermatite atrofica, liquido cerebrospinale in caso di sospetta neuroborreliosi, liquido sinoviale in pazienti con artrite). La ricerca del DNA di Borrelia può essere effettuata anche sulla zecca rimossa dalla cute, dopo aver identificato il genere, da parte degli Istituti Zooprofilattici regionali. La zecca va rimossa il prima possibile per ridurre le probabilità di trasmissione di microrganismi eventualmente presenti all’interno dell’artropode. Molti geni sono stati utilizzati come possibile target nelle metodiche di PCR, ma nella pratica clinica sono usati i geni cromosomiali flaB, p66, 16S rRNA oppure il gene per OspA. Alcuni dati della letteratura mostrano che il rilievo di una PCR negativa non esclude la malattia, a causa della breve presenza e scarsa concentrazione delle Borrelie nel sangue ed in altri fluidi biologici, eccetto biopsia cutanea di EM e di ACA e liquido sinoviale di articolazioni affette da artrite di Lyme. La specificità dei test di PCR utilizzati invece si può ritenere del 98-100%. In Europa sono stati approvati molti kit diagnostici con marchio CE-IVD (European Community marked – in vitro Diagnostic Medical Devices). In USA, la Food and Drug Administration non ha approvato nessun kit di amplificazione genica.
È importante notare che la PCR può essere dirimente nei casi con sintomi persistenti e sierologia dubbia. Sono in corso studi per migliorare il trattamento preliminare dei campioni da sottoporre a PCR, per aumentare la concentrazione di Borrelie.
Ricerca di anticorpi IgG e IgM mediante metodi immunometrici
Le Borrelie possiedono diverse proteine di superficie (OSP A-F) che, oltre ad essere importanti fattori di virulenza ed a permettere l’attacco alle cellule, inducono la produzione di anticorpi specifici di tipo IgG e IgM. Sono disponibili diversi sistemi automatizzati per la ricerca di tali anticorpi anti-Borrelia burgdorferi complex, che utilizzano tecniche differenti: Enzyme-linked immunosorbent assay (EIA), saggi in Chemiluminescenza (CLIA), saggi in fluorescenza (IFA, ELFA). I primi test, nati negli anni ’80, utilizzavano Borrelie coltivate e distrutte mediante sonicazione, mentre i test più recenti, dagli anni 2000, utilizzano antigeni ricombinanti o sintetici di Borrelia burgdorferi complex, in particolare VlsE e C6 (oltre a OspC, p100, p18, p41) oppure una miscela di entrambi, ed hanno una migliore sensibilità e specificità. In Europa esiste una scarsa standardizzazione ed armonizzazione tra i risultati di laboratori diversi.
La risposta immunitaria si caratterizza per la comparsa di:
- Anticorpidi classe IgM(immunoglobuline M) che solitamente sono rilevati nel sangue circa 1-2 settimane dall’infezione. I livelli di IgM raggiungono il massimo a 3-6 settimane, poi iniziano a diminuire.
- Anticorpidi classe IgG(immunoglobuline G) che cominciano a comparire dopo 4-6 settimane dall’infezione e raggiungono il picco dopo circa 4-6 mesi, insieme alla sintomatologia della fase disseminata, e possono rimanere alti per anni.
Sono in corso di sperimentazione test rapidi per la ricerca di anticorpi, del tipo di quelli utilizzati per la diagnostica sierologica di infezione da SARS-CoV-2, mediante immunocromatografia e microfluidica.
Ricerca di anticorpi IgG e IgM Western Blot/Immunoblot
Si tratta di un test di conferma che permette di determinare contemporaneamente la presenza nel siero e nel liquido cerebrospinale in caso di sospetta neuroborreliosi di anticorpi diretti contro i diversi antigeni di Borrelia burgdorferi complex. Tali antigeni vengono disposti su un supporto, in strisce trasversali (dette bande). In USA vengono utilizzate Borrelia sensu stricto coltivate, mentre in Europa vengono utilizzati antigeni ricombinanti di Borrelia garinii e afzelii, inclusi VlsE e OspC e lettura automatizzata. I criteri per la valutazione del risultato sono diversi in USA rispetto all’Europa, a seguito delle diverse caratteristiche delle Borrelie che circolano. In Europa la reazione viene considerata positiva per IgM quando risultano visibili 1 o più bande su 5 e per IgG quando sono visibili 2 o più bande su 10. I principali limiti di questo test sono la soggettività dell‘interpretazione (particolarmente per le IgM), i costi elevati e i lunghi tempi di refertazione.
In generale l’utilità dei test sierologici dipende dalle probabilità cliniche ed epidemiologiche che esistono prima di effettuare il test e dai conseguenti valori predittivi nella situazione specifica in cui il paziente si trova (viaggi/soggiorni in zone ad alta diffusione di zecche, manifestazioni cliniche tipiche, attività a rischio, stagione dell’anno, presenza o assenza di protezione utilizzata, ecc).
La sensibilità dei test sierologici per Borrelia dipende inoltre dal tempo trascorso dall’acquisizione dell’infezione, essendo inferiore quando i test sono applicati nelle primissime fasi della malattia. Sono state riportate (ECDC 2016) sensibilità medie del 50% per eritema migrante (manifestazione precoce), del 77% per neuroborreliosi e del 95% per acrodermatite cronica atrofica (manifestazioni tardive). In totale la sensibilità media riportata è dell’80% circa: quindi nel 20% dei casi un test sierologico potrebbe essere negativo anche in presenza di malattia. I test sierologici sono altamente specifici quando eseguiti ed interpretati secondo le Linee Guida correnti (LG IDSA 2020). Il test però può risultare falsamente positivo in presenza di infezioni causate da batteri simili a Borrelia (come accade in caso di varie malattie trasmesse da altri tipi di zecche o della sifilide) o di altre patologie quali disturbi autoimmuni.
Gli esami sierologici possono essere ripetuti 3-6 settimane più tardi se il sospetto di ML rimane elevato, in quanto il test di primo livello può risultare negativo per la non ancora sopravvenuta siero-conversione; inoltre, una terapia antibiotica effettuata nella fase precoce può impedire completamente lo sviluppo della risposta anticorpale. Nelle forme croniche, gli anticorpi specifici possono permanere per molti anni e vengono quindi utilizzati nella diagnostica di artrite e neuroborreliosi tardiva.
Infatti, i pazienti con infezione in stadio avanzato sono raramente sieronegativi. Tuttavia, il verificarsi di test falsi positivi in pazienti con altre infezioni o condizioni può portare a diagnosi errate e trattamento inappropriato. La sierologia rimane comunque il test di laboratorio più utilizzato nella pratica routinaria, effettuata secondo l’algoritmo a due livelli, come indicato al punto successivo “Come e Perché”.
Come e Perchè
I test per la malattia di Lyme sono eseguiti per determinare se i segni e i sintomi presenti sono dovuti ad un’infezione causata da Borrelia burgdorferi. Tali sintomi possono comparire anche dopo anni dalla puntura di zecca, se non è stata eseguita la terapia antibiotica. Si tenga inoltre conto che la zecca in fase di ninfa è piccolissima ed è possibile non notare la puntura. In alcuni pazienti i sintomi possono essere del tutto aspecifici, simili a quelli dell’influenza.
Una recente revisione (2019) di 16 Linee Guida Europee e Americane per la diagnosi della Borreliosi di Lyme ha rilevato concordanza fra tutte le Linee Guida sull’uso di due metodi diversi (algoritmo a due livelli) per confermare la diagnosi di Malattia di Lyme in tutte le fasi, tranne che nell’eritema migrante precoce: 1 test immunometrico (EIA/CLIA) e 1 test western blot (strategia originariamente proposta dai CDC statunitensi negli anni ‘90).
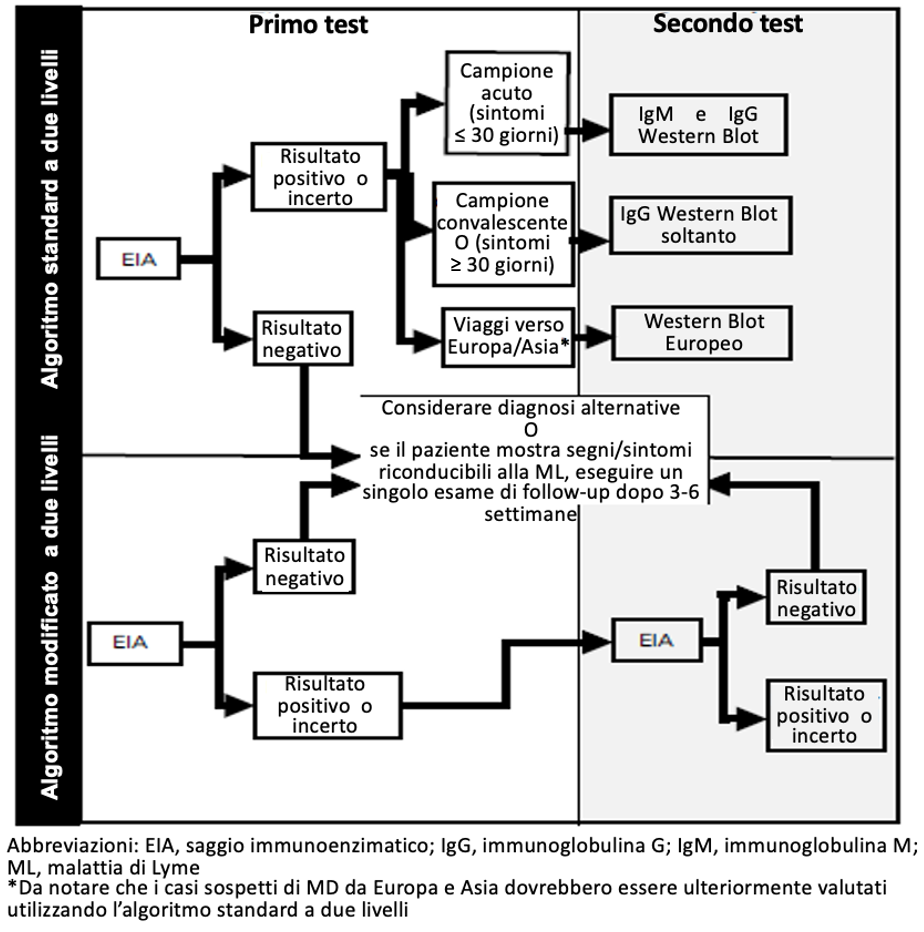
Nell’algoritmo standard a due stadi, utilizzato in USA fino al 2019, il test di primo livello per rilevare gli anticorpi IgM e/o IgG anti-Borrelia può essere di tipo immunoenzimatico o immunofluorescente/chemiluminescente. Se il risultato è negativo non sono necessari ulteriori test; se il risultato è positivo o indeterminato (dubbio) si procede con il test di secondo livello (Western Blot): Il risultato finale viene considerato positivo solo se il primo e il secondo test sono entrambi positivi o uno dei due è indeterminato.
La sensibilità di questo algoritmo a due livelli è però bassa (30%-40%) durante la fase precoce di infezione, quando la risposta immunitaria si sta ancora formando (periodo finestra), mentre è alta nella fase disseminate della malattia (70%-100%). La specificità è alta (>95%) durante tutti gli stati della malattia. In USA nel 2019 la FDA (Food and Drug Administration) ha approvato test immunometrici (EIA) più evoluti e sensibili e il CDC ha proposto (MMWR N° 68/2019) un algoritmo a 2 test immunometrici, usati in modo contemporaneo o sequenziale, cosiddetto algoritmo a 2 livelli modificato, come alternativa equivalente all’algoritmo standard precedente, con vantaggi in termini di standardizzazione, tempi di refertazione, costi, sensibilità e specificità. Tale strategia ha una maggiore sensibilità nella fase precoce (60% circa) e una specificità del 99.5%. In USA questa strategia è stata applicata per i casi osservati in Nord America, mentre per i soggetti che hanno viaggiato in Europa viene ancora utilizzato l’algoritmo standard, con western blot con i ceppi europei.
Nel 2020 in Canada la rete dei Laboratori di Sanità Pubblica ha accolto l’algoritmo a 2 livelli con 2 test EIA validati dal CDC e sono in corso ulteriori studi in regioni a bassa prevalenza di Borreliosi in Canada. In Europa la situazione è più complessa, a causa delle diverse genospecie, e meno standardizzata. Al momento, l’algoritmo modificato con 2 test EIA è stato sperimentato nel 2020 nei Paesi Bassi. Sono necessari ulteriori studi per validarne l’uso in Europa.
Algoritmo standard a due livelli: 1° test EIA, 2° test Western blot (2016 Current Guidelines, Common Clinical Pitfalls, and Future Directions for Laboratory Diagnosis of Lyme Disease, United States)
Algoritmo modificato a due livelli: 1° test EIA, 2° test EIA (CDC 2019, MMWR Vol. 68, N°32, 2019; Lyme Disease Diagnostics Working Group Canadian Communicable Diseases Report 2020 vol. 46)
In casi particolari il campione può essere sottoposto a PCR (reazione a catena della polimerasi). In Europa la PCR viene utilizzata per conferma, oltre alla sierologia a 2 livelli in caso di neuroborreliosi precoce e tardiva (su siero e liquor), eritema migrante, linfocitoma, acrodermatite cronica atrofica (su biopsia cutanea), artrite (su liquido sinoviale). La sensibilità diagnostica della PCR è più elevata nel liquido sinoviale rispetto al sangue e al liquido cerebrospinale. La maggior parte delle linee guida europee e la linea guida 2020 della Società Americana di Malattie Infettive (IDSA) raccomandano di ricercare la produzione di anticorpi nel liquor cerebrospinale, in rapporto agli anticorpi nel siero, come gold standard per la diagnosi di neuroborreliosi precoce. Le LG 2020 non raccomandano l’esecuzione della PCR o della coltura di routine del liquor o del siero in caso di neuroborreliosi.
Nel caso di soggetti con lesioni caratteristiche per eritema migrante, la diagnosi viene posta esclusivamente su base clinica senza effettuare alcun test sierologico per iniziare la terapia il prima possibile.
Domande Frequenti
Per maggiori informazioni riguardo al trattamento, si può consultare l’articolo Linee guida per la diagnosi e il trattamento della malattia di Lyme della Fondazione GIMBE e la Linee Guida 95 dell’aprile 2018 del National Institute for Health and Care Excellence (NICE), riportati nella sezione “Altrove sul web”.
Pagine Correlate
In questo sito
Altrove sul web
Lyme Disease Data Tables: Most Recent Year
EpiCentro, il portale dell’epidemiologia per la sanità pubblica
Centers for Disease Control and Prevention: Lyme Disease
Ixodes ricinus - current known distribution: May 2020
Associazione Lyme Italia e Coinfezioni
Signs and Symptoms of Untreated Lyme Disease
Malattia di Lyme, attenzione alle false credenze
ESCMID Study Group for Lyme Borreliosis - ESGBOR
Linee guida per la diagnosi e il trattamento della malattia di Lyme
Fonti
Hatchette TF, Lindsay LR on behalf of the Lyme Disease Diagnostics Working Group. Modified two-tiered testing algorithm for Lyme disease serology: The Canadian context. Can Commun Dis Rep2020 ;46(5):125–31. https://doi.org/10.14745/ccdr.v46i05a05
CDC Lyme Disease Data Tables: Historical Data Reported cases of Lyme disease by state or locality, 2009-2018 https://www.cdc.gov/lyme/stats/table.html
Lyme borreliosis in Europe https://www.euro.who.int/__data/assets/pdf_file/0008/246167/Fact-sheet-Lyme-borreliosis-Eng.pdf
European Parliament resolution of 15 November 2018 on Lyme disease (Borreliosis) (2018/2774(RSP)) https://www.europarl.europa.eu/doceo/document/TA-8-2018-0465_EN.pdf
Cartabellotta A, Maraolo E, Cartabellotta A, Iacono C. Linee guida per la diagnosi e il trattamento della malattia di Lyme . Evidence 2018;10(9)
Stanek G, Fingerle V, Hunfeld K-P, Jaulhac B, Kaiser R. et al. Lyme borreliosis: clinical case definitions for diagnosis and management in Europe. Clin Microbiol Infect. 2011 Jan;17(1):69-79. doi: 10.1111/j.1469-0691.2010.03175.x
Stanek G, Wormser GP, Gray J, Strle F (2012) Lyme borreliosis. Lancet 379(9814):461–473. https://doi.org/10.1016/S0140-6736(11)60103-7
Lager M, Dessau R, Wilhelmsson P, Nyman D et al. Serological diagnostics of Lyme borreliosis: comparison of assays in twelve clinical laboratories in Northern Europe. European Journal of Clinical Microbiology & Infectious Diseases (2019) 38:1933–1945 https://doi.org/10.1007/s10096-019-03631-x
Branda JA, Linskey K, Kim YA, Steere AC, Ferraro MJ. Two-tiered antibody testing for Lyme disease with use of 2 enzyme immunoassays, a whole-cell sonicate enzyme immunoassay followed by a VlsE C6 peptide enzyme immunoassay. Clin Infect Dis. 2011;53:541–7. 10.1093/cid/cir464
Estrada-Peña A, Cutler S, Potkonjak A. et al. An updated meta-analysis of the distribution and prevalence of Borrelia burgdorferi s.l. in ticks in Europe. Int J Health Geogr 17, 41 (2018). https://doi.org/10.1186/s12942-018-0163-7
Clinical Practice Guidelines by the Infectious Diseases Society of America (IDSA), American Academy of Neurology (AAN), and American College of Rheumatology (ACR): 2020 Guidelines for the Prevention, Diagnosis and Treatment of Lyme Disease. Clinical Infectious Diseases 2021;72(1):e1–e48 DOI: 10.1093/cid/ciaa1215
Trevisan G, Bonin S e Ruscio M. A Practical Approach to the Diagnosis of Lyme Borreliosis: From Clinical Heterogeneity to Laboratory Methods. Front. Med., 23 July 2020 https://doi.org/10.3389/fmed.2020.00265
Lyme Borreliosis (Lyme disease). In: International travel and health [website]. Geneva: World Health Organization; 2014 http://www.who.int/ith/diseases/lyme/en/)
http://www.ecdc.europa.eu/en/healthtopics/vectors/ticks/Pages/ixodes-ricinus.aspx
Kugeler KJ, Schwartz AM, Delorey MJ, Mead PS, Hinckley AF. Estimating the Frequency of Lyme Disease Diagnoses, United States, 2010–2018. Emerg Infect Dis. 2021;27(2):616-619. https://doi.org/10.3201/eid2702.202731
ECDC A systematic literature review on the diagnostic accuracy of serological tests for Lyme borreliosis. Stockholm: ECDC; 2016. doi 10.2900/309479
Anna M. Schotthoefer, Holly M. Frost, Ecology and Epidemiology of Lyme Borreliosis. Clin Lab Med 35 (2015) 723–743 http://dx.doi.org/10.1016/j.cll.2015.08.003 l
Malattia di Lyme, P. Maccallini, 02/ 2016
Climate Change Indicators: Lyme Disease 2015 https://www.epa.gov/climate-indicators/climate-change-indicators-lyme-disease#ref8
Rizzoli A, Hauffe HC, Carpi G, Vourc’h GI, Neteler M, Rosà R. Lyme borreliosis in Europe. Euro Surveill. 2011;16(27):pii=19906. http://www.eurosurveillance.org/ViewArticle.aspx?ArticleId=19906
Hubálek Z. Epidemiology of lyme borreliosis. Curr Probl Dermatol. 2009;37:31-50. doi: 10.1159/000213069. Epub 2009 Apr 8. PMID: 19367096.
Eldin C, Raffetin A, Bouiller K, Hansmann Y, Roblot F, Raoult D, et al. Review of European and American guidelines for the diagnosis of Lyme borreliosis. Med Mal Infect. (2019) 49:121–32. doi: 10.1016/j.medmal.2018.11.011
Sykes RA, Makiello P. An estimate of Lyme borreliosis incidence in Western Europe. J Public Health (Oxf). 2017 Mar 1;39(1):74-81.
Sally Cutler , Muriel Vayssier-Taussat , Agustín Estrada-Peña , AleksandarPotkonjak , Andrei Daniel Mihalca , Hervé Zeller : A new Borrelia on the block: Borrelia miyamotoi - a human health risk? Euro Surveill. 2019 May;24(18):1800170;
Mead P, Petersen J, Hinckley A. Updated CDC Recommendation for Serologic Diagnosis of Lyme Disease. MMWR Morb Mortal Wkly Rep 2019;68:703. DOI: http://dx.doi.org/10.15585/mmwr.mm6832a4
Morbidity and Mortality Weekly Report US Department of Health and Human Services/Centers for Disease Control and Prevention MMWR / August 16, 2019 / Vol. 68 / No. 32 703 Updated CDC Recommendation for Serologic Diagnosis of Lyme Disease
Waddell LA, Greig J, Mascarenhas M, Harding S, Lindsay R, Ogden N. The Accuracy of Diagnostic Tests for Lyme Disease in Humans, A Systematic Review and Meta-Analysis of North American Research PLoS One. 2016; 11(12): e0168613. doi: 10.1371/journal.pone.0168613
Leeflang MM, Ang CW, Berkhout J, Bijlmer HA, Van Bortel W et al. The diagnostic accuracy of serological tests for Lyme borreliosis in Europe: a systematic review and meta-analysis. BMC Infect Dis. (2016) 16:140. doi: 10.1186/s12879-016-1468-4
Trevisan G., Bonin S. and Ruscio M. A Practical Approach to the Diagnosis of Lyme Borreliosis: From Clinical Heterogeneity to Laboratory Methods. Front Med 2020; 7: 265. doi: 10.3389/fmed.2020.00265
Moore A, Nelson C, Molins C, Mead P, Schriefer M. Current Guidelines, Common Clinical Pitfalls, and Future Directions for Laboratory Diagnosis of Lyme Disease, United States. Emerg Infect Dis 2016 Jul;22(7):1169-1177. doi: 10.3201/eid2207.151694.

